Nach einem Schlaganfall sind Gang, Gleichgewicht oder die Arm-Hand-Funktion oft plötzlich eingeschränkt – bis hin zur Lähmung nach Schlaganfall. Gleichzeitig besitzt das Nervensystem eine Fähigkeit, die Fortschritte möglich macht: Neuroplastizität. Sie bedeutet, dass das Gehirn sich durch Übung neu organisiert. Moderne Rehabilitation nach Schlaganfall nutzt dieses Prinzip mit frühem, sicherem Training, aufgabenorientiertem Gangtraining und gezieltem Üben, um den Arm nach Schlaganfall bewegen zu lernen. Neue Technologien wie Robotik-Therapie, Elektrostimulation, Virtual Reality und Telerehabilitation können das Training intensiver und alltagsnäher machen. Dieser Artikel ordnet die Evidenz ein, beschreibt Chancen und Grenzen – und liefert Heimübungen nach Schlaganfall, die viele Betroffene mit fachlicher Anleitung zuhause umsetzen können. Fortschritte sind häufig möglich, aber individuell und meist schrittweise. [1]
Disclaimer: Dieser Artikel informiert evidenzorientiert über Rehabilitation nach Schlaganfall, ersetzt aber keine ärztliche Diagnose oder individuelle Therapieplanung. Bei neuen oder sich verschlechternden Symptomen bitte sofort medizinische Hilfe in Anspruch nehmen. [1]
Definitionen und Grundwissen
Definition: Schlaganfall. Ein Schlaganfall ist eine akute Durchblutungsstörung oder Blutung im Gehirn, die zu plötzlich auftretenden neurologischen Ausfällen führen kann (z. B. Lähmung, Sprach-/Sehstörungen, Verwirrtheit). Moderne Definitionen berücksichtigen neben klinischen Symptomen auch bildgebende Befunde und damit verbundene Gewebeschädigung. [2]
Definition: Mobilitätsverlust nach Schlaganfall. „Mobilität“ meint nicht nur Gehen, sondern auch Aufstehen, Transfers (Bett–Stuhl), Gleichgewicht, sichere Fortbewegung im Alltag und – im weiteren Sinn – die nutzbare Arm-Hand-Funktion für Alltagsaktivitäten. Einschränkungen entstehen häufig durch Schwäche/Parese, Koordinationsstörungen, Sensibilitätsverlust, Spastik, Gleichgewichtsprobleme und/oder Aufmerksamkeits-/Wahrnehmungsstörungen. [3]
Definition: Neuroplastizität. Neuroplastizität beschreibt die Fähigkeit des Nervensystems, Struktur, Funktion oder Verschaltung als Reaktion auf innere oder äußere Reize zu verändern – etwa nach einer Hirnschädigung oder durch Lernen und Training. Genau darauf zielen viele Reha-Strategien ab: häufiges, zielgerichtetes Üben soll „nützliche“ Reorganisation unterstützen. [4]
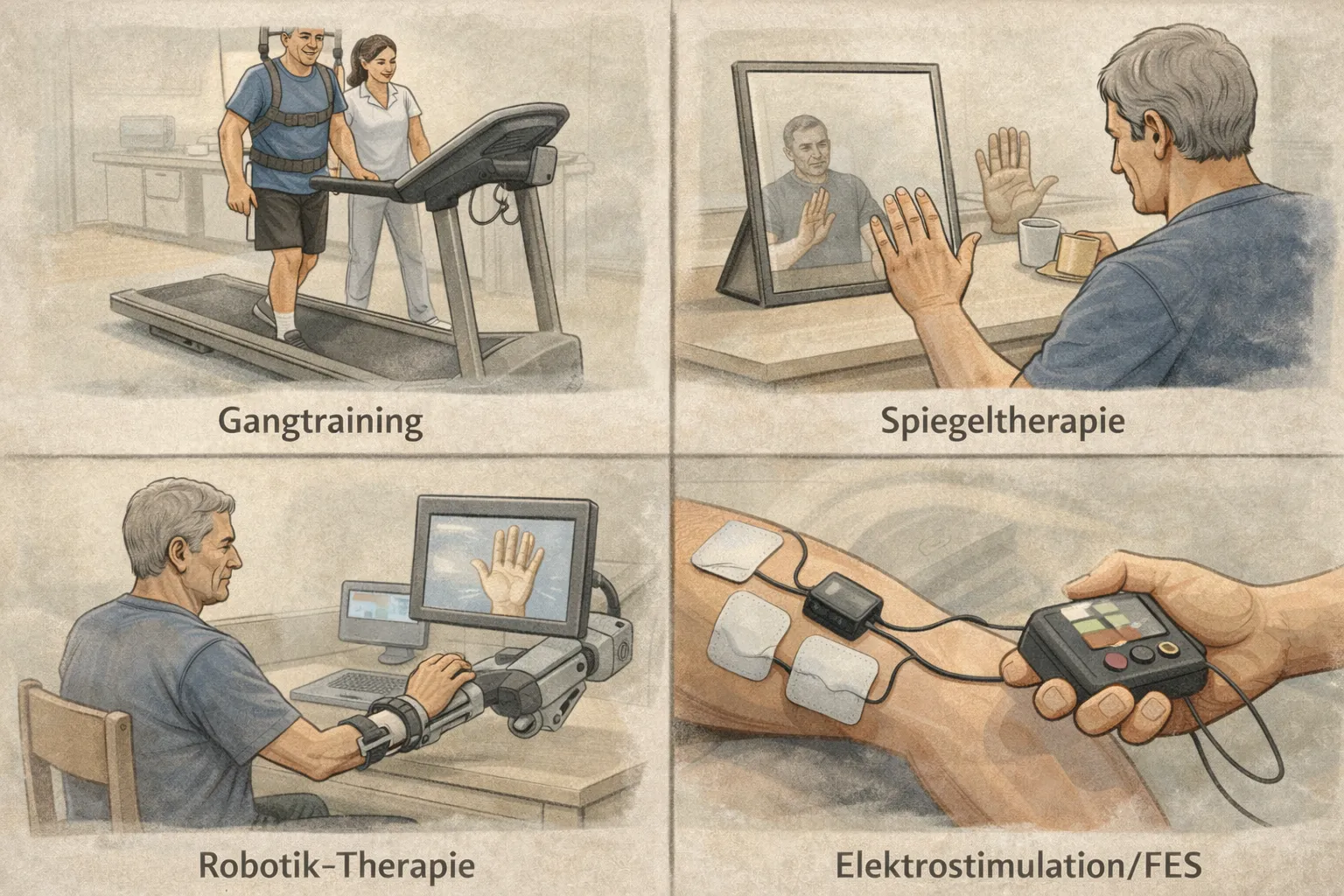
Therapien zur Mobilitätsförderung
Erklärung:
- Gangtraining: therapeutisches Üben des Gehens (z. B. über Boden, Laufband, mit Hilfsmitteln), oft als wiederholte Schritt-/Aufgabenpraxis. [5]
- Spiegeltherapie: Training mit Spiegel/Spiegelbox, bei dem die Bewegung der gesunden Seite als „Spiegelbild“ der betroffenen Seite wahrgenommen wird. [6]
- Robotik-Therapie: Einsatz robotischer Geräte, um Bewegungen sehr häufig, geführt oder assistiert zu üben (Arm/Hand oder Gang). [7]
- Elektrostimulation/FES: elektrische Stimulation zur Aktivierung von Nerven/Muskeln, teils funktionell im Bewegungsablauf (z. B. Fußheber). [8]
- Telerehabilitation: therapeutische Betreuung/Training über Distanz (Video, Apps, Sensor-Feedback), oft als Ergänzung zur Präsenztherapie. [9]
Reha-Phasen und Neuroplastizität
Rehabilitation nach Schlaganfall ist kein „einmaliges Programm“, sondern ein Prozess mit wechselnden Zielen: Komplikationen vermeiden, grundlegende Funktionen wieder anbahnen, dann Ausdauer, Kraft, Koordination und Alltagstätigkeiten systematisch ausbauen. Viele Studien zeigen: Erholung verläuft am schnellsten früh nach dem Ereignis, aber Training kann auch später noch messbare Verbesserungen erzielen – insbesondere, wenn es aufgabenorientiert und ausreichend dosiert ist. [10]
Akutphase
In den ersten Tagen steht die medizinische Stabilisierung im Vordergrund. Gleichzeitig beginnt moderne „Stroke-Unit-Reha“ häufig sehr früh: Lagerung, Atem- und Kreislaufaktivierung, erste Transfers, frühes Aufsetzen/Stehen – immer angepasst an neurologischen Status, Blutdruck, Kreislauf, Schluck-/Sturzrisiko und Begleiterkrankungen. [11]
Wichtig ist die Dosis: Eine große randomisierte Studie zur sehr frühen Mobilisation zeigte, dass ein höher dosiertes „sehr frühes“ Mobilisationsprotokoll in den ersten 24 Stunden mit geringerer Wahrscheinlichkeit für ein günstiges funktionelles Ergebnis nach 3 Monaten verbunden war. Das wird heute häufig so interpretiert, dass „früh“ sinnvoll sein kann – aber nicht „zu viel, zu früh“ und nicht ohne sorgfältige Auswahl und Überwachung. [12]
Frührehabilitation
In den ersten Wochen liegt der Schwerpunkt oft auf dem Wiederlernen zentraler Funktionen: Sitzen, Aufstehen, Gleichgewicht, Gehen, Greifen, Armführung. Evidenzbasierte Reha setzt dabei stark auf wiederholte, alltagsnahe Aufgabenpraxis (z. B. „aus dem Stuhl aufstehen“, „Cup greifen“, „Schritte setzen“), weil genau diese repetitive Aufgabenpraxis funktionelle Fähigkeiten verbessern kann. [13]
Ein realistischer, hilfreicher Gedanke für Betroffene: Frührehabilitation zielt nicht nur auf „Muskelkraft“, sondern auch auf Lernen. Schlaf, Aufmerksamkeit, Motivation und Fatigue beeinflussen, wie gut das Gehirn Trainingsreize „speichert“. [14]
Langzeitrehabilitation
Wenn Monate vergangen sind, sprechen viele von „chronischer Phase“. Das ist kein Synonym für „austherapiert“. Systematische Übersichten zeigen weiterhin Effekte durch gezieltes Training – oft kleiner als in der Frühphase, aber klinisch relevant, besonders bei ausreichend Wiederholungen und sinnvoller Progression. [15]
Prognosefaktoren (was die Chancen beeinflusst): Der wichtigste Prädiktor für Mobilitäts- und Geh-Erholung ist in vielen Untersuchungen die initiale Schlaganfallschwere bzw. das Ausgangsniveau der Funktion. Häufig genannte weitere Einflussfaktoren sind Alter, frühe Geh-/Balancefähigkeit, Muskelkraft (z. B. Kniestrecker), Zeit seit Ereignis sowie kognitive/aufmerksamkeitsbezogene Faktoren. Prognosemodelle können Orientierung geben, sind aber nie „Schicksalsurteile“ für den Einzelfall. [16]
Moderne Schlaganfalltherapie und innovative Ansätze
Leitlinien und große Evidenzsammlungen betonen einen Kern: Training muss spezifisch, wiederholt und sinnvoll gesteigert sein – und es muss zum Ziel passen (Gehen trainiert man durch Schritt-/Stehpraxis; Handfunktion durch Greif-/Manipulationsaufgaben). Technologien sind dabei meist Verstärker: Sie erhöhen Übungsmenge, Feedback und Motivation, ersetzen aber selten die therapeutische Planung. [17]
Gangtraining und Mobilität (Gehfähigkeit, Gehstrecke, Balance).
- Laufbandtraining kann Gehgeschwindigkeit und Ausdauer verbessern; die Effekte sind oft moderat, hängen aber u. a. von Stadium und Trainingshäufigkeit ab. [18]
- Aufgabenorientiertes Training („task-oriented training“) zeigt in Meta-Analysen Verbesserungen von Gang- und Balanceparametern. [19]
- Hochintensives Gehtraining (mehr Schritt-Wiederholungen bei höherer kardiovaskulärer Intensität) gilt als Trend mit wachsender Evidenz, wird aber in der Praxis noch nicht überall umgesetzt – oft wegen Sicherheits-, Personal- und Umsetzungsbarrieren. [20]
Robotik-Therapie und „assistiertes“ Gangtraining. Elektromechanische oder robotisch assistierte Geräte (z. B. Endeffektor-Systeme, Exoskelette) können Gehtraining standardisieren und viele Schritte ermöglichen. Cochrane-Daten zeigen, dass robotisch/elektromechanisch unterstütztes Gehtraining zusätzlich zur Physiotherapie die Chance auf unabhängiges Gehen erhöhen kann; Nutzen und Zielgruppe hängen aber stark von Ausgangsniveau und Setting ab. [21]
Arm-Hand-Rehabilitation: von „Bewegen“ zu „Benutzen“. Viele Patient:innen können Bewegungen teilweise wieder ausführen, setzen den Arm im Alltag aber wenig ein (erlernte Nicht-Nutzung). Hier zielen moderne Programme darauf, die betroffene Seite wieder funktionell in Alltagstätigkeiten zu integrieren. [22]
Constraint-Induced Movement Therapy (CIMT). CIMT (und modifizierte Varianten) kombiniert intensives Üben des betroffenen Arms mit Strategien, den Einsatz im Alltag zu erhöhen. Cochrane-Evidenz beschreibt Effekte auf Arm-Funktion/Alltagsfähigkeit, weist aber auch auf Unterschiede in Protokollen und Eignung hin (nicht jede Person erfüllt die motorischen Voraussetzungen). [23]
Spiegeltherapie. Spiegeltherapie kann motorische Funktionen (Ober- und Unterextremität) und Alltagsaktivitäten moderat verbessern; Nebenwirkungen wurden in Übersichten selten berichtet. Sie ist vergleichsweise niedrigschwellig und wird häufig als Ergänzung eingesetzt. [24]
Robotik-Therapie für Arm/Hand. Robotisch/elektromechanisch assistiertes Armtraining kann Alltagsaktivitäten, Armfunktion und Kraft verbessern; gleichzeitig bleibt offen, welche Dosierung und welche Patientengruppen am meisten profitieren. Unerwünschte Ereignisse wurden in den eingeschlossenen Studien insgesamt selten beschrieben. [25]
Elektrostimulation (NMES/FES).
- Für die obere Extremität berichten Reviews günstige Effekte auf funktionelle Bewegungen, besonders wenn Elektrostimulation in trainingsorientierte Programme eingebettet wird (nicht als „passives Gerätetraining“). [26]
- Bei Fußheberschwäche (Foot Drop) können sowohl Fußheber-FES als auch eine Unterschenkel-Fuß-Orthèse (AFO) die Gehgeschwindigkeit verbessern; Meta-Analysen zeigen im Mittel vergleichbare funktionelle Effekte, sodass die Wahl oft von Passform, Alltagssituation, Hautverträglichkeit, Kosten und persönlicher Präferenz abhängt. [27]
Virtual Reality und Exergaming. Cochrane-Updates deuten darauf hin, dass VR im Vergleich zu alternativen Therapieformen leicht bessere Ergebnisse bei Armnutzung und teils Balance/Teilhabeeinschränkung erzielen kann; unerwünschte Effekte (z. B. Übelkeit/Schwindel, Schmerzen) wurden selten berichtet. Insgesamt sind Effekte häufig klein bis moderat und stark abhängig von Dosis, Inhalt und Betreuung. [28]
Aus der „Innovationsecke“ zur Alltagsumsetzung: In-home-Programme mit spielerischen Elementen („Video-Game-Reha“) und Selbstmanagement wurden in randomisierten Designs untersucht; sie können die Übungszeit zu Hause erhöhen, aber funktionieren am besten, wenn Ziele klar sind und Rückmeldungen/Coaching vorhanden sind. [29]
Telerehabilitation und hybride Modelle. Systematische Reviews zeigen, dass Telerehabilitation in vielen Settings vergleichbare oder ergänzende Effekte auf Mobilität, Balance und Alltagsfunktionen erzielen kann – besonders, wenn sie strukturiert ist und eine therapeutische Rückkopplung enthält. Grenzen liegen u. a. bei schwerer Beeinträchtigung, fehlender Technik, geringer Unterstützung oder wenn Sicherheit (Sturzrisiko) nicht gewährleistet ist. [30]
Neuromodulation (rTMS/tDCS) und Brain-Computer-Interfaces (BCI). Diese Verfahren sind klinisch spannend, aber heterogen: Reviews und Statements sehen Potenzial für motorische und kognitive Outcomes, gleichzeitig variieren Protokolle, Zielregionen, Zeitfenster und Studienqualität. In vielen Versorgungsrealitäten sind sie (noch) Zusatzangebote spezialisierter Zentren, nicht Standard für jede Patientin/jeden Patienten. [31]
Grenzen und Risiken – ehrlich benannt.
- In vielen Bereichen sind Studien klein oder Protokolle sehr unterschiedlich; das erschwert klare „Best-for-all“-Aussagen. [32]
- Frühe Mobilisation braucht Dosierung: „zu viel, zu früh“ kann schaden. [12]
- Heimtraining kann Stürze, Überlastung (z. B. Schulter) oder Hautprobleme bei Elektroden/Orthesen begünstigen, wenn Anleitung, Hilfsmittel oder Sicherheitsmaßnahmen fehlen. [33]
Heimübungen nach Schlaganfall
Heimübungen nach Schlaganfall sind dann am wirksamsten, wenn sie (1) sicher, (2) regelmäßig und (3) zielbezogen sind – idealerweise abgestimmt mit Physio-/Ergotherapie. Das Prinzip dahinter ist gut belegt: Wiederholte Aufgabenpraxis verbessert funktionelle Fähigkeiten. [34]
Sicherheits-Check vor dem Start (kurz):
- Üben Sie nur, wenn Sie sich stabil fühlen (keine akute Infektion, kein Schwindel, keine neue neurologische Verschlechterung). [35]
- Reduzieren Sie Sturzrisiko: rutschfeste Schuhe, freie Wege, feste Abstützfläche (Küchenarbeitsplatte/Handlauf), ggf. eine zweite Person in der Nähe. [36]
- Bei Elektrostimulation oder Orthesen: Nutzen Sie diese nur nach Einweisung und mit passender Indikation. [27]
Übungsbaukasten (Do at Home, alltagsnah):
Wählen Sie 3–5 Übungen, die zu Ihrem Ziel passen, und steigern Sie langsam (mehr Wiederholungen, mehr Qualität, mehr Alltag). [34]
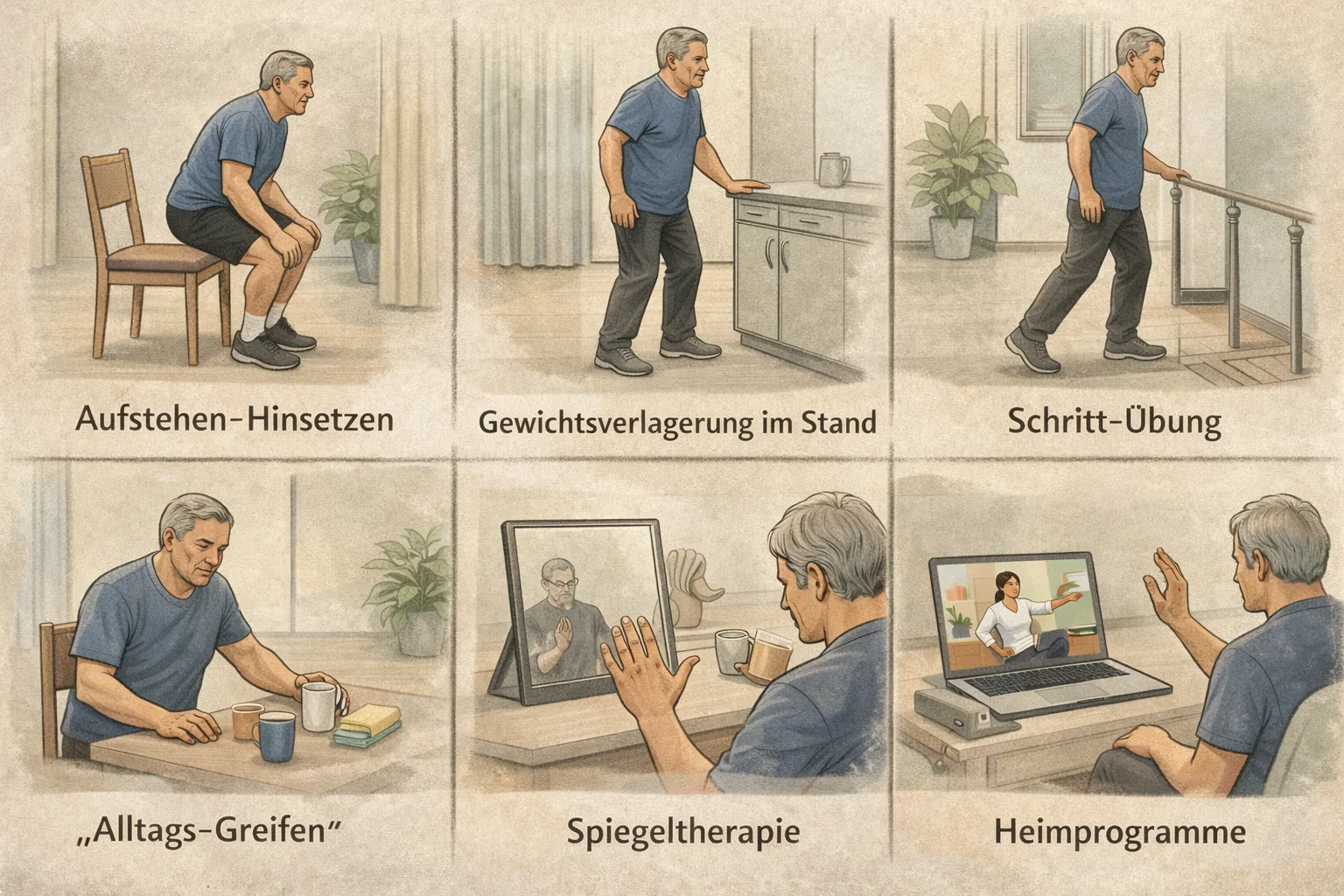
Heimtraining: Alltagsnahe Übungen zur Mobilität
- Aufstehen–Hinsetzen (Sit-to-Stand): Mehrfach aus einem stabilen Stuhl aufstehen und kontrolliert hinsetzen. Ziel: Bein-/Rumpfkraft, Transfers, Balance. [37]
- Gewichtsverlagerung im Stand: Am festen Halt langsam Gewicht rechts/links verlagern, später kleine Kniebeugen oder Fersenheben ergänzen. Ziel: Balance und Gangvorbereitung. [38]
- Schritt-Übung („gezielte Schritte“): Am Halt einen Fuß nach vorn/seitlich setzen und zurückführen; Fokus auf kontrolliertes Abrollen. Ziel: Gangtraining, Koordination. [39]
- „Alltags-Greifen“ für die betroffene Hand: 5–10 Minuten mit großen, sicheren Objekten (Becher, Handtuch, Schwamm) greifen, ablegen, drehen. Ziel: Arm nach Schlaganfall bewegen lernen – funktionell statt „in der Luft“. [40]
- Spiegeltherapie-Routine (10–15 Minuten): Nur, wenn therapeutisch empfohlen: betroffene Hand hinter dem Spiegel, gesunde Hand davor. Langsame, klare Bewegungen (öffnen/schließen, Handgelenk, Finger). Ziel: motorisches Re-Lernen ergänzen. [24]
- Video- oder App-gestützte Heimprogramme: Video-geführte Übungen können die Adhärenz verbessern (weil „was und wie“ klarer ist) – besonders in den ersten Monaten nach Entlassung. [41]
Praxis-Tipp für Angehörige (ohne Druck): Besser 2–3 kurze Einheiten pro Tag als „einmal pro Woche viel“. Für das Gehirn zählt die Wiederholung über Zeit – und die Übung sollte so gestaltet sein, dass Erfolgserlebnisse möglich bleiben. [42]
Disclaimer: Dieser Artikel informiert evidenzorientiert über Rehabilitation nach Schlaganfall, ersetzt aber keine ärztliche Diagnose oder individuelle Therapieplanung. Bei neuen oder sich verschlechternden Symptomen bitte sofort medizinische Hilfe in Anspruch nehmen. [1]

